
bv伟德国际体育、生物治疗国家重点实验室朱晓峰课题组2021年12月2日在Nature Communications (2021, 12:7030)发表了题为“Catalytic flexibility of rice glycosyltransferase OsUGT91C1 for the production of palatable steviol glycosides”的研究论文,报道了糖基转移酶OsUGT91C1参与生物合成新一代健康甜味剂稀有甜味成分的催化机理及应用研发,为解决规模化制备稀有甜味成分的瓶颈问题提供了途径。
甜菊糖苷(steviol glycosides)是从草本植物甜叶菊分离的一系列高甜度、低热量天然甜味组分,目前已在食品和饮料行业得到较广泛的应用。其中甜叶苷(Stevioside)和甜菊糖苷A(Rebaudioside A)是甜菊糖苷天然含量最高的组分,二者虽然甜度高(约为蔗糖甜度的200倍)但口感不好,有明显的后苦味,影响了其应用领域及市场接受度。最近在甜叶菊中发现了两种口感最接近蔗糖的甜菊糖苷D和M(Rebaudioside D、M),它们几乎没有后苦味,是有望取代传统高热量糖的新一代健康甜味剂。不过这两种口感最佳的甜菊糖苷成分是甜叶菊中的稀有组分,天然含量低于0.5%,不可能直接从甜叶菊叶片进行商品化的提炼和纯化,限制了理想甜味成分甜菊糖苷D和M的规模化生产和供给。
通过分析甜菊糖苷生物合成途径(图1),发现位于甜菊糖苷C13-羟基(R1)和C19-羧基(R2)两个方向的特定糖基化,即在上述两个方向形成β (1-3)和β (1-2)糖苷键,是生成甜菊糖苷D和M的必需步骤,决定了甜菊糖苷D和M的天然含量。朱晓峰课题组长期聚焦甜菊糖苷的糖基化进程,前期关于甜菊糖苷β (1-3)糖基化的工作已于2019年发表在Nature Communications (2019, 10:3214),阐明了糖基转移酶UGT76G1在甜菊糖苷C13-羟基和C19-羧基两个方向分别形成β (1-3)糖苷键的催化机理,率先提出了UGT76G1以疏水作用主导底物识别,兼顾底物的双方向识别和特异的糖基转移反应。此外,课题组研究发现甜叶菊自身缺乏在甜菊糖苷C19-羧基方向形成β (1-2)糖苷键的能力,是造成甜菊糖苷D和M天然含量低的直接原因(图1蓝色背景框所示),而水稻来源的糖基转移酶OsUGT91C1可用于弥补甜叶菊β (1-2)糖基化自身催化能力的不足,实现从高丰度低值甜菊糖苷组分到理想甜味成分高品质甜菊糖苷D和M的生物转化。
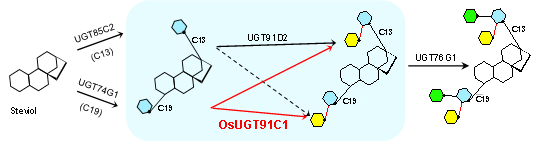
图1 五种糖基转移酶在甜菊糖苷催化形成不同糖苷键的简化示意图(不同颜色的六边形表示甜菊糖苷的各种糖基化修饰,其中绿色表示C13-羟基和C19-羧基两个方向的β (1-3)糖基化,黄色表示上述两个方向的β (1-2)糖基化)
糖基转移酶OsUGT91C1来源于水稻,它的天然底物、产物都与甜菊糖苷无关,虽然可催化甜菊糖苷特定的糖基化反应,但不是以高效合成甜菊糖苷D和M为目的进行进化迭代,因此OsUGT91C1催化甜菊糖苷β (1-2)糖基化的特征、机理,以及在甜菊糖苷D和M转化过程中是否存在不利因素等信息都不清楚。朱晓峰课题组在Nature Communications发表的这篇最新论文,研究并回答了上述问题,揭示了水稻糖基转移酶OsUGT91C1参与甜菊糖苷糖基化过程的反应多样化特征、底物结合模式及对酶目标性能的优化。
研究结果显示糖基转移酶OsUGT91C1在甜菊糖苷糖基化过程中表现出少见的反应多样性特征。虽然它能等效地在甜菊糖苷C13-羟基(R1)和C19-羧基(R2)两个方向催化形成β (1-2)糖苷键(图2a),比甜叶菊自身的糖基转移酶更为高效地参与生物合成甜菊糖苷D和M;但OsUGT91C1同时也会催化糖基化副反应,即催化在甜菊糖苷C13-羟基方向形成β (1-6)糖苷键,给目标产物甜菊糖苷D和M带来杂质和不利影响(图2b)。一般说来,当酶显示出催化反应的多样性,即底物识别模式存在可变性和一定自由度,很难获得匹配各种反应的直接结构信息。课题组解析了OsUGT91C1和一系列甜菊糖苷底物分子的复合物晶体结构,展现了在催化过程中,甜菊糖苷底物可自由翻滚,发生分子的横向旋转及糖基基团的纵向翻转,从而将不同位置的反应基团递送到同一催化位点,直观揭示了匹配OsUGT91C1不同方向,不同形式糖基化反应的底物识别模式,及其相互转换关系(图3),阐明了OsUGT91C1催化多样化糖基转移反应机理的结构基础。
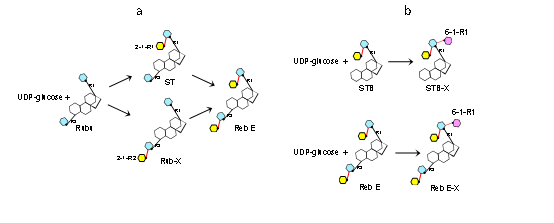
图2水稻来源的糖基转移酶OsUGT91C1在甜菊糖苷糖基化中的典型催化反应示意图
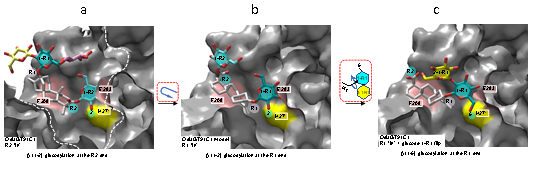
图3 糖基转移酶OsUGT91C1在甜菊糖苷糖基化中三种底物识别模式及相互转换关系
在结构数据的启发下,课题组仅通过突变远离催化中心的两个氨基酸(F379A和F208M),就可破坏副反应的结构基础,避免副反应的发生;而且还将目标β (1-2)糖基化的催化效率进一步提升至原来的3-6倍,为解决甜菊糖苷D和M专一化、规模化制备的瓶颈问题提供了基础。该工作被审稿人认为是‘a beautiful combination of biochemistry, structural biology and rational engineering to develop improved glucosylation catalysts for the production of highly desirable, but rare steviol glycosides’(充分综合运用了生物化学、结构生物学和酶理性改造的技术手段,提升糖基化酶的催化性能,加速了高需求、稀有甜菊糖苷产品的规模化生产)。
生物治疗国家重点实验室的程伟教授也深度参与指导本项目,和朱晓峰教授同为该论文的共同通讯作者。bv伟德国际体育博士生张金珠、硕士生陈禹洁,生物治疗国家重点实验室的汤明海实验师为该论文的共同第一作者。
致谢
该工作得到国家自然科学基金委面上项目,四川省科技创新人才项目的资助。感谢张江实验室国家蛋白质科学研究(上海)设施BL19U1和BL18U1在晶体衍射数据收集的帮助和大力支持。
文章链接:https://doi.org/10.1038/s41467-021-27144-4
